Principi de funcionament de la bateria
Com funciona un rellotge de paret, un comandament a distància del televisor o una joguina infantil amb radiocontrol? La majoria de la gent, sense dubtar-ho, respondrà “de piles” i, en principi, tindran raó. Però és poc probable que cap d'ells pugui dir com es triplica exactament la bateria portàtil, com funciona i sense la qual cosa seria impossible tot el procés de transmissió de corrent elèctric des de la bateria al consumidor final. Omplim aquest molest buit de coneixement.
El contingut de l'article
Principi de funcionament de la bateria
Per entendre el principi de funcionament d'una bateria AA convencional, cal tenir una comprensió general de la seva estructura. Per tant, qualsevol bateria consta de tres elements principals: ànode, càtode i electròlit. A més, aquest últim pot tenir pràcticament qualsevol estat d'agregació: el càtode i l'ànode col·locats en una solució salina, en principi, també són una "bateria", només d'una forma inusual per a la persona mitjana.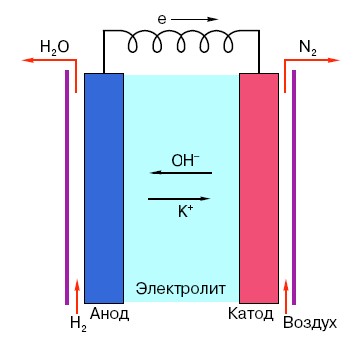
Interessant! L'anomenada "columna voltaica", inventada per Alessandro Volta, també tenia tots els elements necessaris per a la producció de corrent elèctric. Consistia en plaques de zinc i coure apilades unes sobre les altres, entre les quals es col·locava un drap amarat amb àcid com a “capa”.
L'ànode d'aquests sistemes és la principal font d'electrons, que, com sabem en un curs de física escolar, tenen una càrrega negativa.Les partícules carregades negativament se senten atretes per les positives, i en aquest cas la superfície del càtode actua com un "plus".
Però això no és suficient perquè es produeixi un corrent elèctric, perquè els electrons també necessiten una mena d'"autopista", un medi que suporti la interacció del càtode i l'ànode. És aquí on apareix un electròlit "a l'escenari": una sal, un àlcali o un àcid capaç de conduir el corrent.
Vegem el principi de funcionament utilitzant un exemple concret: hi ha una bateria de 18 volts. La tensió entre els elèctrodes que hi ha és estable fins que es connecta a la xarxa. Tan bon punt apareix un consumidor (per exemple, una bombeta normal), el voltatge comença a disminuir gradualment, el corrent comença a fluir de l'elèctrode "negatiu" al "positiu" i es produeix una reacció química a l'electròlit dirigit a mantenint la diferència de potencial entre els elèctrodes.
Referència. Com més energia necessiti el consumidor, més intensa serà la reacció dins de la bateria i més ràpid fallarà.
Com funciona una bateria recarregable, com es diferencia d'una de normal
Per tant, hem mirat les clàssiques bateries "dit" i "dit petit" i sabem que la vida útil de la majoria d'elles és estrictament limitada (no importa el que diguin els fabricants famosos). Però què passa amb les anomenades bateries: bateries tipus bateries que no només poden consumir energia durant el procés de reacció, sinó que també l'acumulen i l'emmagatzemen durant molt de temps?
Per entendre el principi de funcionament de la bateria, cal recórrer a la química. Posem com a exemple... Un foc de carbó normal.Per molt bonica i fascinant que sembli la flama, qualsevol químic que l'observi sap que aquest procés és només una reacció a llarg termini d'oxidació del combustible. La combustió del carbó interacciona amb l'oxigen i com a resultat d'aquesta reacció obtenim:
- diòxid de carboni;
- llum;
- càlid.
I si els dos últims punts són capaços d'escalfar l'ànima i el cos, llavors no podem utilitzar diòxid de carboni de cap manera, perquè és un subproducte de la reacció, que és, de fet, el seu residu. La reacció d'oxidació s'atura quan s'acaben els elements inicials: oxigen i carbó. L'aturada de la reacció en una bateria es produeix exactament de la mateixa manera quan les substàncies de partida s'esgoten completament i només queden "residus".
A la bateria, tot passa una mica diferent. El fet és que la reacció que es produeix en ella pertany a la categoria de reversible, és a dir, en determinades condicions es pot "invertir", tornant totes les substàncies al seu estat original. És la possibilitat que es produeixi una reacció reversible a la bateria que permet carregar-la.
En una bateria connectada a la xarxa, la reacció transcorre en sentit contrari i el corrent flueix de "més" a "menys", i no a l'inrevés. Com a resultat, el producte de reacció forma les substàncies de partida i el propietari de la bateria rep l'energia disponible "recuperada" en un format portàtil. Això és tot!





